ЛЕЧЕНИЕ
Лечение больных с острым гематогенным остеомиелитом начинают по установлении диагноза и осуществляют в трех основных направлениях.
1. Воздействие на макроорганизм, заключающееся в мероприятиях по коррекции нарушений гомеостаза, снижению интоксикации, десенсибилизирующей терапии. Повышение специфической иммунологической реактивности достигается введением плазмы, использованием антистафилококковой гипериммунной плазмы, антистафилококкового-глобулина. Интенсивная иммунизация особенно важна у детей младшей возрастной группы. С целью повышения реактивности организма назначают витамины. Глюкокортикоиды применяют по строгим показаниям только в период выведения больного из состояния септического шока.
2. Антибактериальная терапия состоит в применении комбинации препаратов с учетом механизма их действия, а также в зависимости от чувствительности микрофлоры и ее характера. Возможно сочетанное применение антибиотиков с сульфаниламидами и нитрофуранами. Выбор метода введения препарата зависит от тяжести процесса и его локализации. Внутриартериальное введение обеспечивает наибольшую концентрацию лекарственных веществ в пораженной области. Основными критериями для отмены антибиотиков служат исчезновение воспалительной реакции в очаге поражения, стойкая с 7-го дня нормализация температуры тела ребенка и тенденция к нормализации анализов крови.
3. Местное лечение. Основными задачами санации гнойного очага являются: вскрытие и декомпрессия костно-мозгового канала, эвакуация гноя, подведение антибактериальных препаратов и предотвращение вторичного инфицирования.
Предоперационная подготовка является обязательным и длительность её должна быть интенсивной и не более 6 часов в зависимости от тяжести состояния.
В современных условиях для этой цели наиболее часто применяют оперативное вмешательство, включающее остеоперфорацию, дренирование гнойных очагов в кости и мягких тканях. Несмотря на кажущуюся простоту эта операция при остром остеомиелите имеет существенные особенности, касающиеся выбора рациональных доступов и оперативной техники.
Оперативные вмешательства целесообразно осуществлять через основные разрезы, обеспечивающие минимальную травматизацию мягких тканей и кратчайший доступ к соответствующему отделу пораженной кости.
Первое остеоперфоративное отверстие (не более 5 мм в диаметре) наносят на метадиафиз, последующие на метафиз.
После промывания костно-мозгового канала (растворы фурацилина 1:5000, новокаина 0,25% с антибиотиками) производят дренирование внутрикостного гнойника микроирригаторами (диаметром 3-4 мм), которые вводят через отдельные проколы кожи в стороне от операционной раны.
Основной доступ при необходимости дренирования гнойных затеков может быть дополнен вспомогательными разрезами.
Применение первичного шва позволяет снизить вторичное инфицирование, повысить эффективность применения антибиотиков и других препаратов путем их фракционного введения или использования проточно-вакуумной системы.
Методика местного применения антибиотиков в послеоперационном периоде зависит от стадии воспалительного процесса: при локализации гнойника в губчатом веществе метафиза их вводят через микроирригаторы 1-2 раза в сутки в возрастной дозировке в объеме 3-5 мг 0,25% р-ра новокаина; при распространении флегмоны на костно-мозговой канал и окружающие ткани постоянное или фракционное промывание через систему дренажных трубок. Длительность местного применения антибиотиков и других антисептических средств зависит от динамики местного процесса, общего состояния больного и обычно не превышает 5-7 дней.
Физиотерапевтические процедуры - токи УВЧ назначают через 2-3 дня на пораженную конечность (7-10 сеансов). Затем электрофорез с антибиотиками, хлористым кальцием.
В послеоперационном периоде важно функциональное лечение, которое осуществляют путем активного ведения больного и применения лечебной физкультуры. Это способствует улучшению нервнотрофических процессов, нормализует жизненный тонус организма, крово- и лимфообращение, предупреждает тугоподвижность суставов и, в конечном счете, приводит к положительным сдвигам в динамике репаративных процессов в пораженной кости.
ЛФК начинают на фоне улучшения состояния больного после исчезновения боли при нормальной температуре. В этот момент конечность иммобилизирована. Общеукрепляющие упражнения для здоровых конечностей в крупных и мелких суставах проводят в исходном положении лежа на спине. После исчезновения признаков острого воспаления со стороны мягких тканей, нормализации лейкограммы и снятия швов иммобилизацию, за исключением детей с поражением суставов, прекращают. В процедуру лечебной гимнастики постепенно вводят упражнения для больной конечности. При этом необходимо учитывать, что хотя возможность возникновения патологического перелома мало вероятна, физическая нагрузка на пораженную конечность должна быть снижена.
В последующие дни ребенку вначале разрешают сидеть, а затем обучают ходить на костылях, не опираясь на больную ногу. При поражении парных конечностей и наличии грубых деструктивных изменений на снимках (без угрозы патологического перелома) реабилитационные воздействия не прекращают, при остеомиелите бедренной и плечевой кости их осуществляют используя съемные лонгеты и исключают хождение.
Сроки пребывания больного в стационаре индивидуальны и обусловлены особенностями течения и видом ОГО. Они могут колебаться от 4-5 недель при первичном до 8-10 недель при метастатическом остеомиелите. Дальнейшая реабилитация осуществляется при наблюдении ребенка в условиях поликлиники или санатория.
Больные с ОГО одной из парных костей конечности выписывают с разрешением наступать на пораженную конечность при ходьбе с костылями. При остеомиелите бедренной кости им не рекомендуется опираться на больную ногу в течение месяца, а затем переводят на ограниченный режим ходьбы без костылей. Через 3-4 месяца диспансерного наблюдения дети, имеющие нормальные клинические и биохимические анализы и положительную динамику репаративных процессов в кости на рентгенограммах, переводятся на свободный режим, с освобождением от занятий физкультуры в школе. Занятия физкультурой по школьной программе (в подготовительной группе) разрешают при отсутствии рецидивов и стойких нормальных лабораторных показателях не ранее одного года после выписки ребенка из стационара.
Больным с хронизацией остеомиелитического процесса после одного-двух месяцев домашнего режима показана повторная госпитализация для проведения противорецидивного лечения.
Осложнения
1. Переход заболевания в хроническую форму.
2. Патологический перелом.
3. Патологический вывих.
4. Ложный сустав.
5. Другие местные осложнения (анкилоз, контрактура, деформация конечности, нарушение роста кости).
6. Общие осложнения — амилоидоз внутренних органов.
Ранняя диагностика острого гематогенного остеомиелита (в первые 2-е суток заболевания) на основании клинических данных и дополнительных методов исследования позволяет достигать хороших результатов лечения, предотвращая развитие осложнений.
Учитывая исключительную важность раннего (в первые 48 часов) выявления гнойного поражения костей приводим наиболее простые диагностические алгоритмы, расcчитанные на хирургическое отделение ЦРБ, детские хирургические отделения (И.Н. Григович, 1996).
При пункции костно-мозгового канала в ранние сроки остеомиелита полученное в шприце скудное количество крови может быть использовано для изготовления мазка с целью определения клеточного индекса нейтрофилов (КИН). нижение КИН ниже 0,6 усиливает подозрение на костную инфекцию.
Алгоритм обследования больного с подозрением на острый гемотогенный остеомиелит
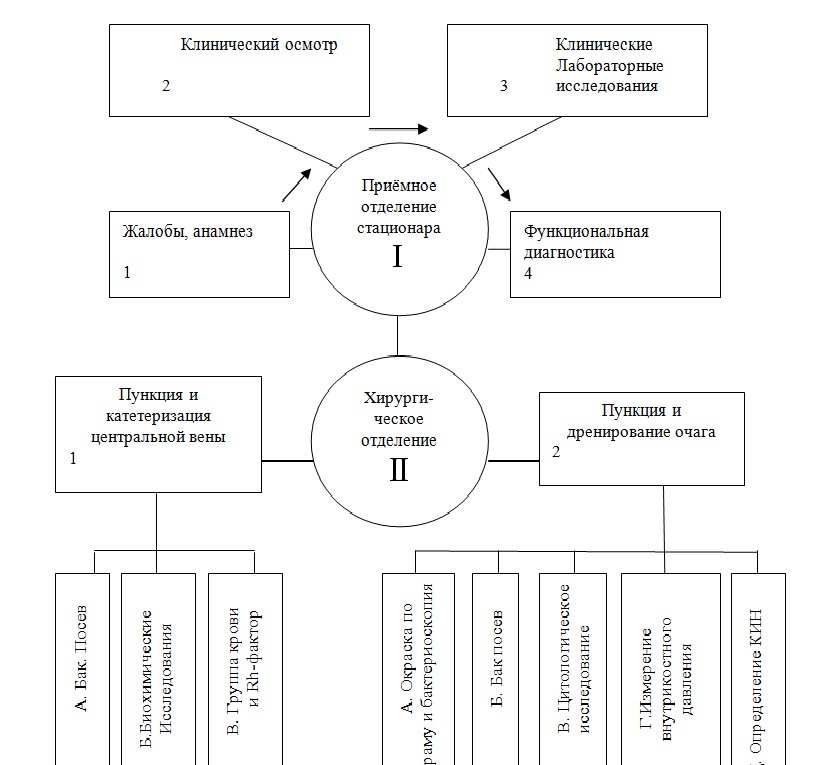
Алгоритм получения информации, подтверждающий или усиливающий подозрение на ОГО


Антибиотикотерапия острого гематогенного остеомиелита.
Рациональная антибиотикотерапия является важным компонентом комплексного лечения ОГО. Для эффективного и безопасного использования АБ следует придерживаться следующих принципов:
1) Перед началом антибиотикотерапии необходима бактериоскопическая (микроскопия мазка, окрашенного по Грамму) и бактериологическая диагностика (выделение возбудителя и определение его чувствительности к антибиотикам).
В настоящее время выделяют эмпирическую и целенаправленную АБТ (антибиотикотерапия). В первом случае речь идет о стартовом режиме, когда возбудитель неизвестен, однако тщательно собранный анамнез (сопутствующие заболевания, давность предыдущего курса АБТ, внебольничное или нозокомиальное заражение, наличие других факторов риска) позволяют очертить «круг» наиболее вероятных в данной клинической ситуации возбудителей и назначить правильную АБТ.
Следует отметить, что до начала стартовой терапии необходимо провести забор биологического материала для бактериологического исследования, при этом исследуется не только очаг хирургической инфекции – с учетом возможности течения септического процесса необходимы посевы крови на стерильность (лучше – 2 - 3-х кратные и из разных вен для исключения ложноположительных результатов из-за возможной контаминации) и других очагов инфекции (плевральный выпот, мокрота, кожные гнойники и т.д.).
Целенаправленной АБТ становится, когда есть результаты бактериологического исследования: высев патогенной флоры и определение ее чувствительности к АБ (антибиотик). Полученные через несколько дней, эти результаты становятся ценным подспорьем для выбора антибиотика 2-го ряда при неэффективности стартовой (эмпирической) терапии. Не следует забывать, что изучение результатов бактериологического исследования имеет важное эпидемиологическое значение: накапливается статистика по остеотропным возбудителям в регионе и конкретном ЛПУ, в дальнейшем врачи назначают эмпирическую терапию ОГО с учетом этих данных.
Наиболее частый возбудитель гематогенного и остеогенного остеомиелита во всех возрастных группах - S.aureus (золотистый стафилококк), как правило – продуцент β-лактамаз, но сохраняющий чувствительность к оксациллину (метициллину) и ингибитор-защищенным пенициллинам (MSSA). Могут встречаться и штаммы, резистентные к оксациллину (метициллину); в этом случае (высев MRSA) все β-лактамные АБ будут неэффективны.
Второе место при гематогенном остеомиелите у детей занимает Streptococcus pyogenes, а у новорожденных - стрептококк группы В (Streptococcus agalactiae), реже встречаются энтеробактерии. У детей младше 4 лет в 10% случаев этиологическим агентом является H.influenzae тип B. У пациентов с серповидноклеточной анемией остеомиелит вызывают Salmonella spp. У подростков помимо S.aureus наблюдается широкий спектр других аэробных и анаэробных кокков и палочек. У пациентов, находящихся на гемодиализе, ИВЛ, а также у наркоманов нередко встречается P.aeruginosa.
В редких случаях ОГО имеет грибковую этиологию. Микрофлора гноя у одного и того же больного с течением времени может меняться. К первоначальной эндогенной инфекции в дальнейшем может присоединиться вторичное экзогенное инфицирование микрофлорой (в том числе – госпитальными штаммами), распространяющейся с поверхности тела по свищевому ходу. Не следует также забывать и о специфической природе ОГО (туберкулез, сифилис, бруцеллез).
2) Тяжелое состояние больного требует парентерального введения препарата (лучше - внутривенно). В ряде случае возможна т.н. ступенчатая антибиотикотерапия (step-down терапия), при этом в начале курса лечения в стационаре антибиотик назначают парентерально, а при положительной динамике состояния больного (в среднем через 3 - 7 дней) переходят на применение пероральной формы препарата. Однако при ОГО возможности step-down терапии ограничены нередким отсутствием перорального аналога антибиотика, применявшегося парентерально, и степенью его абсорбции в ЖКТ (см. ниже).
3) Лечение внебольничной инфекции как правило проводится одним антибиотиком. При внутрибольничной инфекции может потребоваться комбинация двух антибактериальных препаратов с возможным добавлением антимикотика.
4) При отсутствии клинико-лабораторного эффекта от антибиотика в течение первых 48-72 ч лечения производится его замена (продолжение его применения “курсом 7-10 дней” неоправданно). Смена АБ сопровождается обязательной ревизией этиологического диагноза и пересмотром фармакодинамического спектра (важно не дублировать «неудачный» препарат!).
5) Критериями отмены антибиотиков являются отсутствие интоксикации, исчезновение клинических симптомов, эрадикация возбудителя, отсутствие значительных Rö-изменений, нормализация картины периферической крови, показателей С-РБ и прокальцитонина. Длительность терапии составляет не менее 4 недель.
6) По возможности следует избегать назначения в стартовом режиме препаратов широкого или ультраширокого спектра действия. Практика деэскалационной терапии должна применяться только у больных в критическом состоянии при высокой вероятности летального исхода в случае неэффективности стартовой антибактериальной терапии; препараты ультраширокого спектра действия, назначенные в режиме эмпирической терапии тяжелой инфекции, после стабилизации состояния больного и получения микробиологических данных (возбудителя, антибиотикограммы) могут быть заменены препаратами более узкого спектра, т.е проводится деэскалация.
7) Антибиотик должен обладать высокой органотропностью, т.е. способностью накапливаться в пораженной кости, создавая там концентрации, значительно превышающие МПК антибиотика для данного возбудителя. При этом надо помнить и о сопутствующих очагах инфекции в других органах – антибиотик должен создавать эффективные концентрации во всех пораженных органах и тканях.
8) Антибиотик должен обладать высокой степенью безопасности: превышение его дозы даже в несколько раз не должно приводить к токсическому эффекту (антибиотик должен иметь широкий “коридор безопасности”). К сожалению, не все препараты соответствуют этому требованию, и использование их в максимальных (т.е. субтоксических) дозах требует контроля их концентрации в крови и мониторирования возможных побочных эффектов (снижение слуха при назначении аминогликозидов, снижение свертываемости крови и возможность гепатоцитолиза при лечении цефалоспоринами, снижение показателей «белой крови» при длительном использовании оксациллина, тиенама, ванкомицина и др.). Здесь уместно напомнить, что при сочетании ОГО с септическим шоком, вызванным Gr«–» бактериями, назначение больших доз бактерицидных антибиотиков может вызвать синдром Яриша-Герксгеймера: бактериолиз, массивную эндотоксинемию и усугубление инфекционно-токсического шока.
9) Антибиотик должен обладать хорошей переносимостью: у него должно отсутствовать неблагоприятное воздействие терапевтических концентраций на организм ребенка. Однако, многие препараты, и, прежде всего – линкомицин, вызывают угнетение микрофлоры кишечника и развитие антибиотико-ассоциированной диареи.
10) Антибиотик должен иметь длительный период полувыведения (Т½), что позволяет снизить частоту инъекций.
Выбор антимикробных препаратов.
С учетом наиболее вероятной флоры (стафилококки, стрептококки), стартовая терапия должна перекрыть Gr«+» кокки. Препаратами выбора являются оксациллин, амоксициллин/клавуланат, ампициллин/сульбактам или цефазолин. Альтернативные препараты: при аллергии на β-лактамные АБ - линкозамиды (линкомицин, клиндамицин), при высеве MRSA – ванкомицин или – при плохой переносимости ванкомицина - линезолид.
Если по результатам микроскопии в патологическом материале обнаружены Gr«–» бактерии (энтеробактерии, псевдомонады), назначают цефтриаксон, цефотаксим или антисинегнойные цефалоспорины: цефтазидим, цефоперазон или цефепим. При тяжелом течении эти препараты комбинируют с аминогликозидами (гентамицин, амикацин, нетилмицин) или назначают карбапенемы (имипенем/циластатин, меропенем, эртапенем), в т.ч. – для деэскалационной терапии.
При подозрении на анаэробную инфекцию назначают карбапенемы, цефоперазон/сульбактам, ингибитор-защищенные пенициллины или метронидазол.
При подозрении на полимикробную инфекцию (при сахарном диабете, иммунодефиците) назначают карбапенемы или цефоперазон/сульбактам ± аминогликозиды.
Для детей до 4 лет наряду с другими микробами актуальна Haemophilus influenzae типа b. При уверенности в этой этиологии следует использовать монотерапию цефалоспоринами III (цефтриаксон, цефотаксим) или IV (цефепим) поколения (более ранние генерации недостаточно активны). Учитывая, что благодаря вакцинам Пентаксим, Хиберикс и Акт-ХИБ прослойка вакцинированных против H.influenzae детей в популяции растет, на первый план в этом возрасте выходит Gr«+» кокковая флора.
Дозы антибиотиков при лечении ОГО
|
Антибиотик |
Суточные дозы |
Кратность введения (в сутки) |
|
Оксациллин |
100-200 мг/кг |
4-6 |
|
Амоксициллин/клавуланат |
60-100 мг/кг (по амоксициллину) |
3-4 |
|
Ампициллин/сульбактам |
100 мг/кг (по ампициллину) |
3-4 |
|
Цефазолин |
50-100 мг/кг |
3-4 |
|
Цефтриаксон |
50-75 мг/кг |
1-2 |
|
Цефотаксим |
50-100 мг/кг |
2-3 |
|
Цефтазидим |
50-100 мг/кг |
2-3 |
|
Цефоперазон |
50-200 мг/кг |
2 |
|
Цефоперазон/сульбактам |
80-160 мг/кг (по цефоперазону) |
2-3 |
|
Цефепим |
50-100 мг/кг |
2-3 |
|
Имипенем/циластатин |
60 мг/кг |
4 |
|
Меропенем |
60 мг/кг |
3 |
|
Ванкомицин |
40 мг/кг |
4 |
|
Линезолид |
30 мг/кг |
3 |
|
Гентамицин |
2-5 мг/кг |
2-3 |
|
Амикацин |
15 мг/кг |
2 |
|
Нетилмицин |
6-9 мг/кг |
2-3 |
|
Линкомицин |
30-60 мг/кг |
2-3 |
|
Клиндамицин |
25-40 мг/кг |
3-4 |
|
Метронидазол |
22,5 мг/кг |
3 |
