Тематический план
МЕТАДАННЫЕ
Курс создан доцентом Института Фармации Камаевой С.С., доцентом Института Фармации Меркурьевой Г.Ю.
Дата начала эксплуатации курса: 05.07.2024
Доступность: записанные на курс пользователи
Язык интерфейса: русский
URL: https://e.kazangmu.ru/course/view.php?id=3299#section-1




Дисциплина: Фармацевтическая экология
Код и специальность (направление подготовки): 33.04.01 ПРОМЫШЛЕННАЯ ФАРМАЦИЯ
Квалификация: магистр
Уровень МАГИСТРАТУРА
Форма обучения: очная
Институт фармации
Курс: 2
Третий семестр
Лекции 14 часов
Практические занятия 44 часа
СРС 86 часов
Всего 144 час.
Зачетных единиц трудоемкости (ЗЕТ) 4Цель освоения дисциплины: сформировать у обучающихся компетенции в области основ общей экологии и специальной фармацевтической экологии, необходимые для решения вопросов в сфере рационального природопользования и минимизации влияния факторов загрязнения окружающей среды при организации работы химико-фармацевтических предприятий.
Задачи освоения дисциплины:
1. Раскрыть основные понятия фармацевтической экологии и ее роли в профессиональной деятельности провизора
2. Оценить возможности влияния факторов фармацевтической промышленности на окружающую среду3. Рассмотреть влияние фармацевтической промышленности на здоровье человека
В третьем семестре:
Лекции 14 часов (7 лекций х 2 часа)
Практические занятия 44 часа (11 занятий х 4 часа)1. Электронный каталог научной библиотеки Казанского ГМУ. Собственный ресурс. http://library.kazangmu.ru/jirbis2/index.php?option=com_irbis&view=irbis&Itemid=108
2. Электронно-библиотечная система КГМУ (свидетельство о регистрации СМИ Эл№ФС77-68965 от 07.03.2017г.) http://e-lib.kazangmu.ru/lib/
3. Электронно-библиотечная система «Консультант студента» (договор поставки № 2/2020 от 2.03.2020г., срок доступа: 02.03.2020г.-31.12.2020г.) http://www.studentlibrary.ru
4. Научная электронная библиотека eLibrary.ru (договор № SU-17-01/2020-1 от 30.01.2020г., срок доступа: 30.01.2020г.- 31.12.2020г.) http://www.elibrary.ru
5. Справочная правовая система «Консультант плюс» (договор о сотрудничестве № 497Р\2020 от 03.02.2020г.), доступ с компьютеров библиотеки
6. Меdlinе – медицинская реферативно-библиографическая база данных/система поиска. (Система PubMed предоставляет доступ к Medline.
Раздел 1. ФАРМАЦЕВТИЧЕСКАЯ ЭКОЛОГИЯ. ОТХОДЫ ФАРМАЦЕВТИЧЕСКИХ ПРЕДПРИЯТИЙ.
ТЕМА 1.1. Фармацевтическая экология. Отходы фармацевтических предприятий.
ЗАНЯТИЕ 1. Фармацевтическая экология. Источники выбросов загрязняющих веществ в окружающую среду. Предприятия фармацевтического сектора как источник загрязнения окружающей среды. Отходы фармацевтических предприятий. Природоохранное законодательство.



ЗАНЯТИЕ 2. Фармацевтическая экология. Источники выбросов загрязняющих веществ в окружающую среду. Предприятия фармацевтического сектора как источник загрязнения окружающей среды. Отходы фармацевтических предприятий. Природоохранное законодательство.



Тема 1.2. Сточные воды
ЗАНЯТИЕ 3. Сточные воды. Классификация сточных вод химических производств. Нормирование качества сточных вод. Методы очистки и обезвреживания производственных сточных вод. Методы анализа сточных вод. Загрязняющие вещества. Методики анализа загрязняющих веществ




ЗАНЯТИЕ 4. Сточные воды. Классификация сточных вод химических производств. Нормирование качества сточных вод. Методы очистки и обезвреживания сточных вод. Методы анализа сточных вод. Загрязняющие вещества. Методики анализа загрязняющих веществ.





ТЕМА 1.3.ПРОМЫШЛЕННЫЕ ВЫБРОСЫ.
ЗАНЯТИЕ 5. Очистка промышленных выбросов от пыли и газов. Методы отбора проб и анализа загрязняющих веществ в промышленных выбросах. Химические и физические методы анализа загрязняющих веществ в промышленных выбросах. Определение концентрации пыли в воздухе рабочей зоны.




ЗАНЯТИЕ 6.
Очистка промышленных выбросов от пыли и газов. Методы отбора проб и анализа загрязняющих веществ в промышленных выбросах. Химические и физические методы анализа загрязняющих веществ в промышленных выбросах. Определение концентрации пыли в воздухе рабочей зоны.




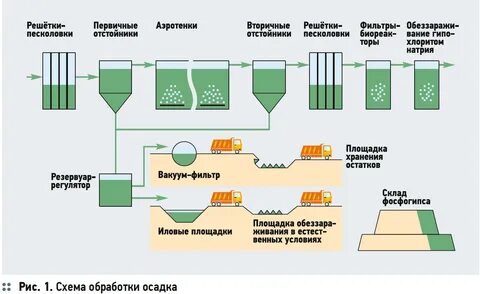
ТЕМА 1.4. ОТХОДЫ ПРОИЗВОДСТВА
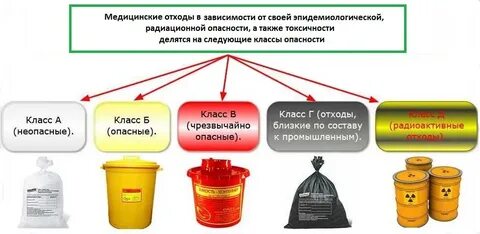
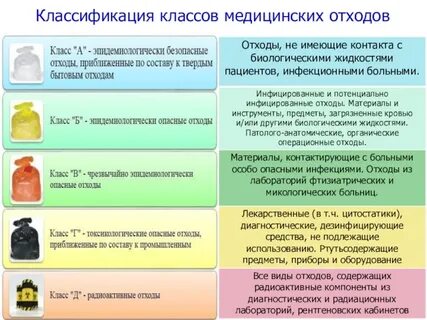
ЗАНЯТИЕ 7. Отходы производства и потребления. Предельно допустимые концентрации почвы. Классы токсичности отходов. Переработка отходов. Безотходное и малооотходное производство. Медицинские отходы. Законодательство в области обращения с медицинскими отходами. Паспорта отходов.




РАЗДЕЛ 2. ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ
ТЕМА 2.1. Загрязнение окружающей среды тяжелыми металлами
ЗАНЯТИЕ 8. Загрязнение окружающей среды тяжелыми металлами, пестицидами, радионуклидами. Методы анализа тяжёлых металлов. Определение тяжёлых металлов в лекарственных формах.

Тема 2.2. Загрязнение окружающей среды пестицидами и радионуклидами
ЗАНЯТИЕ 9. Загрязнение окружающей среды пестицидами и радионуклидами


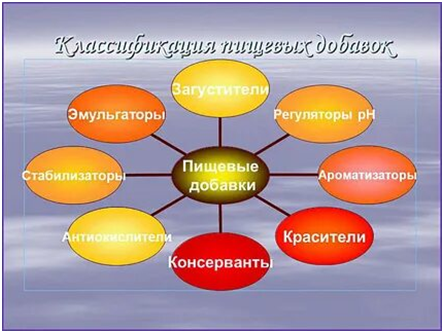
ТЕМА 2.3. Пищевые добавки
ЗАНЯТИЕ 10. ТЕМА 2.3. Пищевые добавки, классификация пищевых добавок




Темы докладов по теме «Пищевые добавки. БАД»
1. Вещества, влияющие на вкус пищевых продуктов. Подсластители.
2. Вещества, влияющие на аромат пищевых продуктов. Пищевые эссенции.
3. Пищевые добавки, усиливающие и модифицирующие вкус и аромат
4. Пищевые красители. Классификация. Области применения. Характеристика.
5. Консерванты в производстве пищевых продуктов. Их классификация и характеристика.
6. Пищевые добавки, замедляющие микробиологическую порчу пищевого сырья и готовых продуктов. Антибиотики.
7. Пищевые антиокислители
8. Применение загустителей и гелеобразователей в производстве пищевых продуктов. Целлюлоза и ее производные
9. Крахмалы и модифицированные крахмалы в пищевом производстве
10. Каррагинаны в пищевом производстве. Классификация. Характеристика. Области применения.
11. Пектины и камеди в производстве пищевых продуктов
12. Полисахариды морских растений в производстве пищевых продуктов
13. Эмульгаторы в производстве пищевых продуктов, их классификация. Характеристика глицеридов.
14. Применение фосфолипидов в производстве пищевых продуктов. Их роль и характеристика. Лецитин.
15. Сорбитаны, лактилаты в производстве пищевых продуктов
ЗАНЯТИЕ 11. ТЕМА 2.4. ИТОГОВОЕ ЗАНЯТИЕ

.
